Germinación de Moringa Oleifera L. con la aplicación de ecomic ® y dos bioestimulantes sintéticos en condiciones controladas
Contenido principal del artículo
Resumen
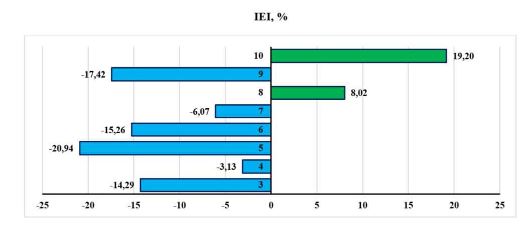
En condiciones controladas, se evaluó el efecto de EcoMic® (Glomus cubense), TOMATICID y VIUSID® AGRO en la germinación de Moringa oleifera Lam. El experimento se realizó en bandejas de espuma de poliuretano, en casa de cristal. Se sembraron cuatro semillas en cada pozuelo, que contenía 120 g de sustrato. Se inocularon las semillas con los bioproductos, según recomendaciones del fabricante. Se aplicó un diseño completamente aleatorizado, con 10 tratamientos y 10 repeticiones. Se realizó un análisis ANOVA y las diferencias entre medias se determinaron según LSD de Fisher. En la germinación acumulada, a los 10 después de la siembra, el tratamiento 10 (EcoMic®, al momento de la siembra y VIUSID® AGRO, a los cinco días después de la siembra, 43.81 %) fue superior al control absoluto y a los tratamientos 3 (EcoMic®), 4 (TOMATICID), 5 (VIUSID® AGRO) y 7 (EcoMic® VIUSID® AGRO) al momento de la siembra. En la germinación parcial, el tratamiento 10 (30.71 %) a los cinco días después de la siembra, así como los tratamientos 8 (EcoMic® + VIUSID® AGRO + TOMATICID, 45.52 %) y 6 (EcoMic® + TOMATICID, 41.53 %) al momento de la siembra, fueron superiores al resto, excepto al 9 (EcoMic®, MS + TOMATICID) cinco días después de la siembra. En el índice de germinación total, el tratamiento 10 (14,46) superó a los demás, excepto al 8 y al testigo fertilizado. El índice de velocidad de la germinación mostró que el 10 (0.45) fue superior a los demás. Se concluye que la combinación de EcoMic® y VIUSID® AGRO, cinco días después de la siembra, así como la de EcoMic® + VIUSID® AGRO + TOMATICID y EcoMic® + TOMATICID, al momento de la siembra, aceleraron la germinación parcial a los 10 días después de la siembra con respecto al resto de los tratamientos. La combinación EcoMic® (MS) y VIUSID® AGRO a los cinco días después de la siembra influyó notablemente en la velocidad de la germinación y uniformidad del vigor de las semillas, por lo que pudiera constituir una ventaja para el establecimiento de plántulas en vivero. El efecto de los bioproductos en la capacidad germinativa de las semillas se correspondió con el efecto sobre su vigor y uniformidad.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
Citas
Angelovici, R., Fait, A., Fernie, A.R. & Galili, G. 2011. A seed high-lysine trait is negatively associated with the TCA cycle and slows down Arabidopsis seed germination. New Phytologist, 189(1): 148–159, ISSN: 1469-8137. https://doi.org/10.1111/j.1469-8137.2010.03478.x.
Anon. 2007. Statgraphics centurion XV. Dyna, 82(1): 7, ISSN: 0012-7361.
Bennett, J.A. & Cahill Jr, J.F. 2016. Fungal effects on plant–plant interactions contribute to grassland plant abundances: evidence from the field. Journal of Ecology, 104(3): 755–764, ISSN: 1365-2745. https://doi.org/10.1111/1365-2745.12558.
Ballina, H.S., Ruiz-Sánchez, E., Ambriz, E. & Alvarado, C.J. 2017. Efecto de la luz y micorrizas en la germinación de semillas de árboles de selvas secas. Madera y Bosques, 23(3): 29-37, ISSN: 2448-7597. https://doi.org/10.21829/myb.20117.2331531.
Barberá, C. 1989. Pesticidas agrícolas. Productos de acción fisiológica. 4ta edición. Ediciones Omega S.A. Barcelona. 350 p.
Bernardo, V., Garita, S., Ripodas, J. I., González, M., Arango, C. & Ruscitti, M. 2020. Micorrizas arbusculares, aplicaciones en el sector agro-forestal. Pp. 64-88. En: Micorrizas arbusculares. Biología y aplicaciones en el sector agro-forestal. Mario Carlos Nazareno Saparrat, Marcela Fabiana Ruscitti y Maria Cecilia Arango (coordinadores). EDULP. Libro digital. 135 p. ISBN 978-987-8348-41-4.
Borjas-Ventura, R., Julca-Otiniano, A. & Alvarado-Huamán, L. 2020. Las fitohormonas, una pieza clave en el desarrollo de la agricultura. Journal of the Selva Andina Biosphere, 8(2): 150-164, ISSN: 2308-3859. http://doi.org/10.36610/j.sab.2020.080200150.
Barraza F.A., Benavides O.B. & Torres, F.M. 2016. Calidad fisiológica y energía de germinación de semillas de balsamina (Momordica charantia L.). Revista de Ciencias Agrícolas, 33(1): 43-52, ISSN: 2256-2273. http://dx.doi.org/10.22267/rcia.163301.5.
Bover-Felices, K., López-Vigoa, O., Rizo-Álvarez, M. & Benítez-Álvarez, M.Á. 2017. Efecto del EcoMic® y el Pectimorf® en el crecimiento de plántulas de Leucaena leucocephala cv. Cunningham. Pastos y Forrajes, 40(2): 102-107, ISSN: 2078-8452.
Cadillo, G.A. 2022. Efecto de bioestimulantes en las características agronómicas del cultivo de Moringa (Moringa oleifera) bajo condiciones de vivero en Vegueta- Huaura. Tesis en opción al título de Ingeniero Agrónomo. Universidad Nacional José Faustino Sánchez Carrión. Facultad de ingeniería agraria, industrias alimentarias y ambiental. Huacho, Perú. 126 p.
CATALYSIS. 2018. VIUSID® Agro, promotor del crecimiento. Available at: http://www.catalysisagrovete.com Consulted: December 14, 2023
Ede, A.E., Ndubuaku, U.M. & Baiyeri, K.P. 2015. Media Effects on Emergence and Growth of Moringa (Moringa oleifera Lam) Seedlings in the Nursery. American Journal of Experimental Agriculture, 7(3): 182–189, ISSN: 2231-0606. https://doi.org/10.9734/AJEA/2015/13602.
Espindola, Y., Romero, L., Ruiz, R. & Luna, C. 2018. Influencia de las condiciones de incubación sobre la germinación de semillas de diferentes individuos de Pterogyne nitens. Quebracho-Revista de Ciencias Forestales, 26(1): 5-17, ISSN: 1851-3026.
Font Quer, P. 1975. Diccionario Botánico. Edit. Labor S.A. Barcelona. 1244 p. ISBN: 84-335-5804-8.
Gavica, B.E. & Gómez, A.S. 2019. Efecto de diferentes dosis de VIUSID ®agro aplicadas durante cuatro etapas de crecimiento y desarrollo del cultivo de frijol (Phaseolus vulgaris L.). Proyecto especial de graduación presentado como requisito parcial para optar al título de Ingeniero Agrónomo. Escuela Agrícola Panamericana, Zamorano, Honduras. 22 p.
González-Zertuche, L. & Orozco-Segovia, A. 1996. Métodos de análisis de datos en la germinación de semillas, un ejemplo: Manfreda brachystachya. Boletín de la Sociedad Botánica de México, 58: 15-30, ISSN: 0366-2128. https://doi.org/10.17129/botsci.1484.
Guzmán-Albores, M.J., Ramírez-Merchant, M.L., Interiano-Santos, E.C., Manzano-Gómez, L.A., Castañón-González, J.H., Winkler, R., Abud Archila, M., Montes-Molina, J., Gutiérrez-Miceli, F. & Ruíz-Valdiviezo, V. 2019. Metabolomic and Proteomic Analysis of Moringa oleifera Cultivated with Vermicompost and Phosphate Rock under Water Stress Conditions. International Journal of Agriculture & Biology, 21(4): 786-794, ISSN: 1814-9596. https://doi.org/10.17957/IJAB/15.0957.
Hernández, S.A.H. 2016. Efecto de la aplicación de Biozyme TF sobre la germinación de semilla de Moringa oleifera Lam. Tesis de Licenciatura. Universidad Autónoma Agraria Antonio Narro, Buenavista, Saltillo, Coahuila, México. 65pp.
Islam, S., Mia, A.B., Hossain, J., Ahmed, J., Uddin, S.J., Haider, I. & Khan, M.A. 2012. Priming on embryo emergence and seedling vigor of small fruited bitter gourd (Momordica charantia L.) under suboptimal temperature. Agricultural and Food Sciences, 2: 1-10, ISSN: 0975-9107.
Knopf, E., Blaschke, H. & Munch, J. 2013. Improving Moringa Growth by Using Autchthonous and Allochthonous Arbuscular Mycorrhizal Fungi in Lake Victoria Basin. West African Journal of Applied Ecology, 21(1): 47-57, ISSN: 2661-9040.
Knopf, E., Blaschke, H., Munch, C., Murage, A., Kirika, P & Osaka, S. 2016. Impacts of soil on Mycorrizal fungi: growth responses of Moringa spp. Plants sampled from Lake Victoria Basin. Journal of Biological Sciences, 16(1-2): 12-21, ISSN: 1812-5719.
Laínez, P.E. 2021. Efecto de dos bioestimulantes en la producción de mudas de melón (Cucumis melo). Trabajo de Integración Curricular para la obtención del título de Ingeniera Agrónoma. Universidad Estatal de Santa Elena, Ecuador. 46 p.
Lamí-Izquierdo, L., Díaz-Luzbet, M., García-Bassa, C., Mesa-Jardín, M., Cabrera-Lejartí, M., Lores-Nápoles, M.N., Crespo-Zayas, D. & Álvarez-Delgado, A. 2011. Obtención y generalización del empleo de uma fitohormona sintética para aumentar el rendimento del tomate y otros frutos. ICIDCA. Sobre los derivados de azúcar, 45(2): 10-18, ISSN: 1025-3076.
Mehta, D., Kanwar, H., Thakur, A., Thakur, S. & Thakur, K. 2014. Standardization of seed hydro-priming duration in bitter gourd, Momordica charantia L. International Journal of Bio-resource and Stress Management, 5(1): 98 – 101, ISSN: 0976-4038.
Meot-Duros, L. & Magné, C. 2008. Effect of salinity and chemical factors on seed germination in the halophyte Crithmum maritimum. Plant and Soil, 313(1-2): 83-87, ISSN: 1573-5036.
Murali, M., Raj., A.J. & Wani, A.M. 2023. Effect of Seed Treatment with Bio Fertilizers on Germination Plant Height and Total Biomass of Annual Moringa (Moringa oleifera L.). Current Journal of Applied Science and Technology, 42 (34): 15-22, ISSN: 2457-1024. https://doi.org/10.9734/CJAST/2023/v42i344229.
Noda, Y. & Castañeda, L. 2012. Efecto de EcoMic® en la emergencia de plántulas de Jatropha curcas (Nota Técnica). Pastos y Forrajes, 35(4): 401-406, ISSN: 2078-8452.
Noguera-Talavera, A., Reyes-Sánchez, N. & Mendieta-Araica, B. 2018. Guía de establecimiento vivero moringa (Moringa oleifera). Manejo de viveros de Marango. Guía Técnica N°21. Una alternativa sostenible de alimentación animal ante el cambio climático. Universidad Nacional Agraria Promarango. 27 p.
Núñez, D. 2018. Efecto de bioestimulantes agrícolas en la supervivencia y el crecimiento de plantas in vitro de caña de azúcar (Saccharum spp.) en la fase de aclimatización ex vitro. Tesis presentada en opción al título académico de Máster en Ingeniería Agrícola. Universidad Central ʺMarta Abreuʺ de Las Villas, Facultad de Ciencias Agropecuarias. 78 pp.
Oquendo, G. 2014. Descripción, establecimiento y uso de las principales arbóreas: Moringa oleifera. En: Uso de arbóreas como recurso sostenible para la crianza animal. Ed.: José M. Argenter, Holguín. Cuba. 112 p.
Padilla, C., Fraga, N. & Suárez, M. 2012. Efecto del tiempo de remojo de las semillas de moringa (Moringa oleifera) en el comportamiento de la germinación y en indicadores del crecimiento de la planta. Cuban Journal of Agricultural Science, 46(4): 419-421, ISSN: 2079-3480.
Peña, C.K., Rodríguez, F.J.C. & Meléndrez, G.J.F. 2015. Efecto de un promotor del crecimiento activado molecularmente sobre la germinación y la producción de frijol (Phaseolus vulgaris L.). Infociencia, 19 (3): 1-12, ISSN: 1029-5186.
Pina, J.C., Oliveira, AKMd., Matias, R. & Silva, Fd. 2018. Influência de diferentes substratos na produção de fitoconstituintes de Moringa oleifera lam. cultivada a pleno sol. Ciência Florestal, 28: 1076-1087, ISSN: 1980-5098.
Pita, A. 2014. Efecto de Glomus fasciculatum Tul., en la nutrición y el crecimiento de Moringa oleifera Lam, en un suelo Fersialítico Rojizo Ócrico Eútrico. Tesis presentada en opción al grado científico de Doctor en Ciencias Forestales. Universidad de Pinar del Río, Pinar del Río, Cuba. 112 p.
Plana, R.R., González, P.J. & Soto, F. 2016. Combined use of EcoMic®, Fitomas-E® and mineral fertilizers in the forage production of animal food based in triticale (x. Triticosecale Wittmack), cv. INCA TT-7. Cultivos Tropicales, 37(4): 76-83, ISSN: 1819-4087.
Posada, L.F., Moreno, A.E., Santos, M.T. & Estrada, G.A. 2021. Mecanismos de promoción de crecimiento de las PGPB. Pp. 80-104. En: Bacterias promotoras de crecimiento vegetal en Sistemas de Agricultura Sostenible. Ruth Bonilla Buitrago, Luz Estela González de Bashan, Raúl Osvaldo Pedraza (Eds.). Corporación colombiana de investigación agropecuaria – Mosquera (Colombia): AGROSAVIA. 372 p. ISBN E-book: 978-958-740-501-9. ISBN: 978-958-740-500-2.
Ramírez, E.A. 2019. Efecto de consorcios PGPR sobre el desarrollo de plantas de Plukenetia volubilis y Moringa oleifera hasta fase vegetativa en comparación a fertilización convencional y orgánica en campo. Trabajo de grado para optar por el título de microbiólogo industrial. Universidad de Santander, facultad de ciencias exactas, naturales y agropecuarias. Bucaramanga, Santander, Colombia. 100 p.
Reyes-Pérez, J.J., Rivero-Herrada, M., Andagoya-Fajardo, C.J., Beltrán-Morales, F.A., Hernández-Montiel, L.G., García Liscano, A.E. & Ruiz-Espinoza, F.H. 2021. Emergencia y características agronómicas del Cucumis sativus a la aplicación de quitosano, Glomus cubense y ácidos húmicos. Biotecnia, 23(3): 38-44, ISSN: 1665-1456.
Rivera, R., Fernandez, F., Fernandez, K., Ruiz L., Sánchez, C. & Riera, M. 2011. Advances in the management of effective arbuscular mycorrhizas symbiosis in tropical ecosystems. In Chantal Hamel and Christian Plenchette (eds.) Mycorrhizas in Crop Production (pp. 151-196). Binghamton, NY: Haworth Press.
Sandoval-Rangel, A., Tapia, A., Cabrera-De la Fuente, M., González, J.A. & Benavides-Mendoza, A. 2018. Edad, beneficio y ácido giberélico afectan la germinación y producción de planta de chile piquín. Revista Mexicana de Ciencias Agrícolas, 9(20): 4199-4209, ISSN: 2007-9230. https://doi.org/10.29312/remexca.v0i20.990.
Santillana, N., Zúñiga, D. & Arellano, C. 2012. Capacidad promotora del crecimiento en cebada (Hordeum vulgare) y potencial antagónico de Rhizobium leguminosarum y Rhizobium etli. Agrociencia Uruguay, 16: 11-17, ISSN: 2730-5066.
Scott, S.J., Jones, R.A. & Williams, W.A. 1984. Review of data analysis methods for seed germination. Crop Science, 24: 1129-1199, ISSN: 1435-0653. https://doi.org/10.2135/CROPSCI1984.0011183X002400060043X.
Serbelló, F.G., Mesa, J. R. & Soto, R. 2014. Efecto de diferentes alternativas biológicas, sobre el porcentaje y velocidad de germinación de las semillas de fruta bomba (Carica papaya L.). Revista Científica Agroecosistemas, 2(1): 247-253, ISSN: 2415-2862.
Silva, P., Andrade, L.A., Venia, C.S., Fabricante, J.R. & Silva, M. 2012. Comportamiento germinativo de sementes de Moringa oleifera Lam diferentes ambientes y tiempos de almacenamiento. Agropecuaria Científica no Semiárido, 8: 1-6, ISSN: 1808-6845.
Simbaña, C.C.L. 2011. Estudio de las propiedades físicas y funcionales de un hidrolizado enzimático de proteína a escala piloto y su aplicación como fertilizante. Available at: http://bibdigital.epn.edu.ec/bitstream/15000/3762/1/CD-3535.pdf. Consulted: May 20, 2014
Terry, E., Ruiz, J., Tejeda, T. & Reynaldo, I. 2014. Efectividad agrobiológica del producto bioactivo Pectimorf® en el cultivo del Rábano (Raphanus sativus L.). Cultivos Tropicales, 35(2): 105-111, ISSN: 1819-4087.
Van de Venter, A. 2000. Seed vigor testing. Journal of New Seeds, 2(4): 51-58, ISSN: 1522-9025. https://doi.org/10.1300/j153v02n04_06.
Vital, V.I., Quiñones, A.E., Hernández, M.L. & Rincón, E.G. 2018. Viabilidad de esporas de hongos micorrízicos arbusculares y semillas de girasol para el establecimiento de la simbiosis micorrízica. Biotecnología y Sustentabilidad, 3(2): 15-25, ISSN: 2448-7562.
Wasy, A.A., Shyanmalamma, S. & Nache, G.V. 2010. Influence of bio-inoculants on nursery establishment of papaya cv Solo. Acta Horticulturae, 851: 389-394, ISSN: 2406-6168.
Weitbrecht, K., Muller, K. & Leubner-Metzger, G. 2011. First off the mark: early seed germination. Journal of Experimental Botany, 62(19): 3289-3309, ISSN: 1460-2431. https://doi.org/10.1093/lxb/err030.